geführt von
Dr. Thibault Cholvin
Mithilfe der In-vivo-Zweiphotonen-Kalziumbildgebung bei verhaltensgestörten Mäusen untersuchen wir, wie das Gehirn Erfahrungen in kortiko-hippocampalen Netzwerken erfasst und langfristig speichert.

Forschung
Wir erforschen die räumliche Navigation und das episodische Gedächtnis bei verhaltensgestörten Mäusen. Mithilfe der Zwei-Photonen-Kalzium-Bildgebung in vivo verfolgen wir die Aktivität von Neuronen über längere Zeiträume (mehrere Tage/Wochen) und beleuchten so die Eigenschaften der verschiedenen Unterregionen des Hippocampus (CA1, CA3, DG) sowie deren kortikale Eingänge (wie die axonalen Projektionen aus dem entorhinalen Kortex). Dazu kombinieren wir Zwei-Photonen-Bildgebung und virtuelle Realität, um die Aktivität von Hunderten von Neuronen oder Axonen gleichzeitig zu erfassen, während die Maus durch virtuelle Umgebungen navigiert. Schließlich nutzen wir die aufgezeichnete Zell- oder Axonaktivität, um den gleichzeitigen Standort und die Umgebung der Tiere zu entschlüsseln und so auf die relative Beteiligung dieser Hirnregionen am räumlichen Gedächtnis zu schließen.
Teckniken
In-vivo-Zweiphotonen-Kalzium-Bildgebung
Wir führen Zwei-Photonen-Kalzium-Bildgebung bei Mäusen durch, die den Kopf fixieren und zielgerichtete Aufgaben in vertrauter oder virtueller Umgebung ausführen.
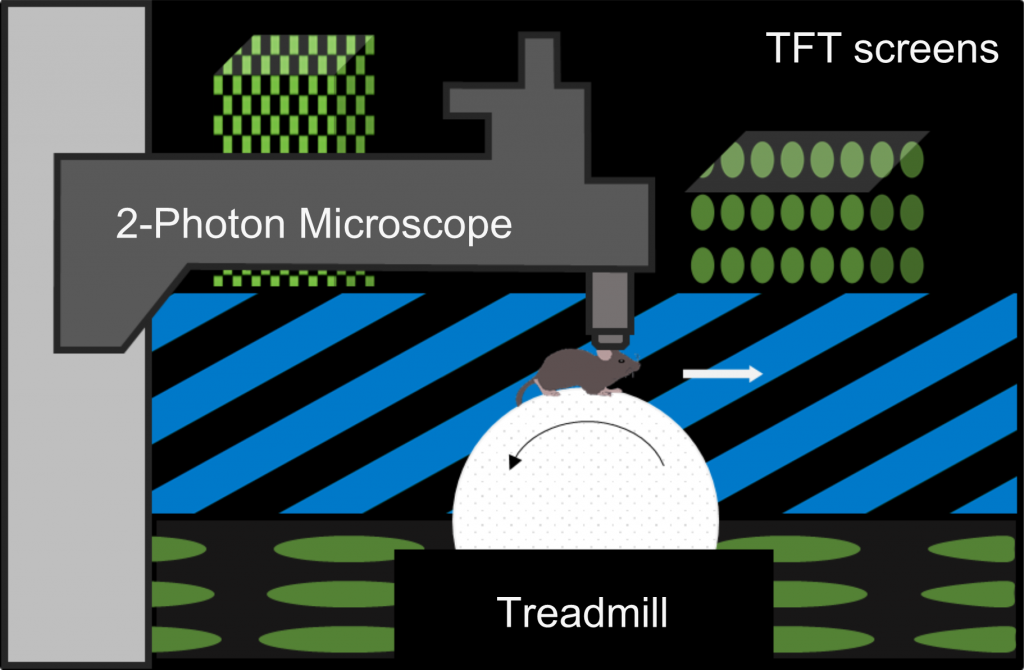
Das Tier steht auf einer luftgetragenen Styroporkugel, die es ihm ermöglicht, durch virtuelle Welten zu navigieren, während seine tatsächliche Position konstant bleibt.
Die Bildschirme sind in einem sechseckigen Bogen um die Maus herum angeordnet und befinden sich in einem Abstand von ca. 25 cm vom Kopf des Tieres. Sie decken ~260° des horizontalen und ~60° des vertikalen Gesichtsfeldes der Maus ab.

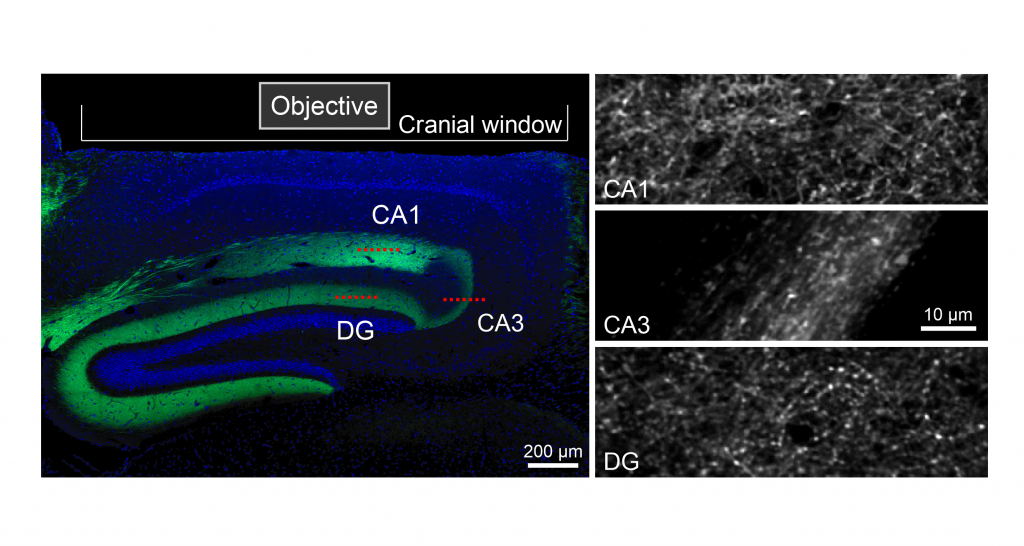
Wir verwenden in vivo Zwei-Photonen-Kalzium-Bildgebung, um die Aktivität von Hunderten von Zellen in der einen oder anderen Subregion des Hippocampus gleichzeitig zu erfassen. In diesem Beispiel haben wir GCaMP im Hippocampus panneuronal exprimiert, so dass wir die Pyramidenzellen in CA1 und CA3 sowie die Körnerzellen des Gyrus dentatus abbilden konnten.

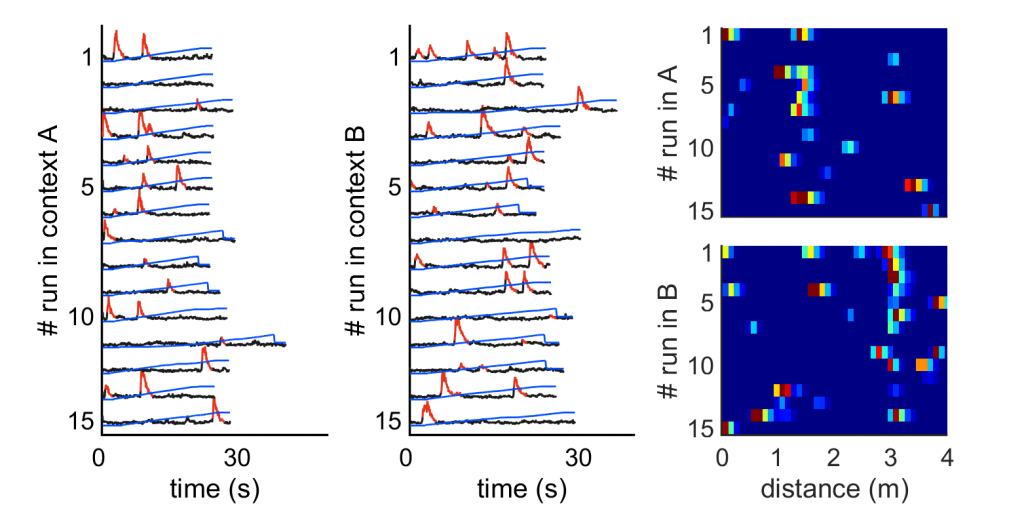
Die nachstehenden Kurven zeigen die Aktivität einer einzelnen Körnerzelle über 15 Durchläufe in zwei verschiedenen Umgebungen; beachten Sie das zuverlässige Vorhandensein eines Ortsfeldes in Kontext A, im Gegensatz zum auffälligen Fehlen der Aktivität dieser Zelle in Kontext B.
Dieses Video zeigt ein typisches Beispiel für ein Sichtfeld, das eine große Population von Körnerzellen umfasst, die wir in unseren Experimenten abbilden können.
Die In-vivo-Zweiphotonen-Kalziumbildgebung kann auch auf axonale Projektionen angewandt werden, so dass wir die Aktivität von Hunderten von Axonendigungen erfassen können, die von Neuronen in entfernten Hirnregionen (wie dem entorhinalen Kortex) stammen und in den Hippocampus projizieren.
Die folgenden Spuren zeigen die Aktivität eines einzelnen Boutons (Axonterminal) über 15 Durchläufe in zwei verschiedenen Umgebungen; beachten Sie das Vorhandensein von Ortsfeldern in beiden Kontexten, jedoch an unterschiedlichen Stellen je nach Kontext (remapping).
Dieses Video zeigt ein typisches Beispiel für das Sichtfeld, das zahlreiche axonale Projektionen vom MEC zum Gyrus dentatus (mittlere Molekularschicht) umfasst, wie wir sie in unseren Experimenten abbilden können.
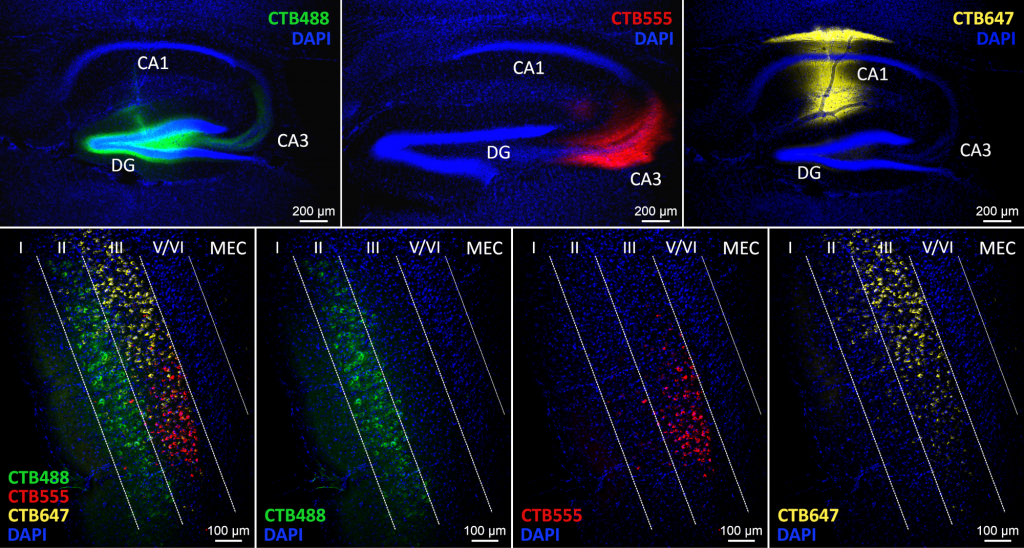
Mit retrograden Tracern wie Choleratoxin Untereinheit B (CTB), die mit verschiedenen Fluorophoren (z. B. Alexa Fluor 488 (grün), 555 (rot) oder 647 (blau)) konjugiert sind, können wir mehrere neuronale Bahnen innerhalb desselben Gehirns untersuchen, z. B. die Projektionen vom entorhinalen Kortex zu bestimmten Unterregionen des Hippocampus. In dem hier vorgestellten Beispiel wurden drei verschiedene CTB-Varianten in CA1, CA3 bzw. DG bei einem einzigen Tier injiziert, um die Unterschiede (z. B. die Schichtspezifität) in der Konnektivität zwischen dem entorhinalen Kortex und den einzelnen Unterregionen des Hippocampus aufzuzeigen.
Chemogenetische Hilfsmittel wie Designer-Rezeptoren, die ausschließlich durch Designer-Drogen aktiviert werden (auch bekannt als DREADDs), ermöglichen die Fernsteuerung neuronaler Aktivitäten. DREADDs sind künstlich hergestellte Muscarin- oder Opioidrezeptoren, die so lange stumm bleiben, bis sie durch spezifische Liganden (die durch eine einfache intravenöse Injektion verabreicht werden können) aktiviert werden. Je nach Typ können DREADD-Rezeptoren entweder eine Zunahme (hM3Dq) oder eine Abnahme (hM4Di) der neuronalen Aktivität bewirken.
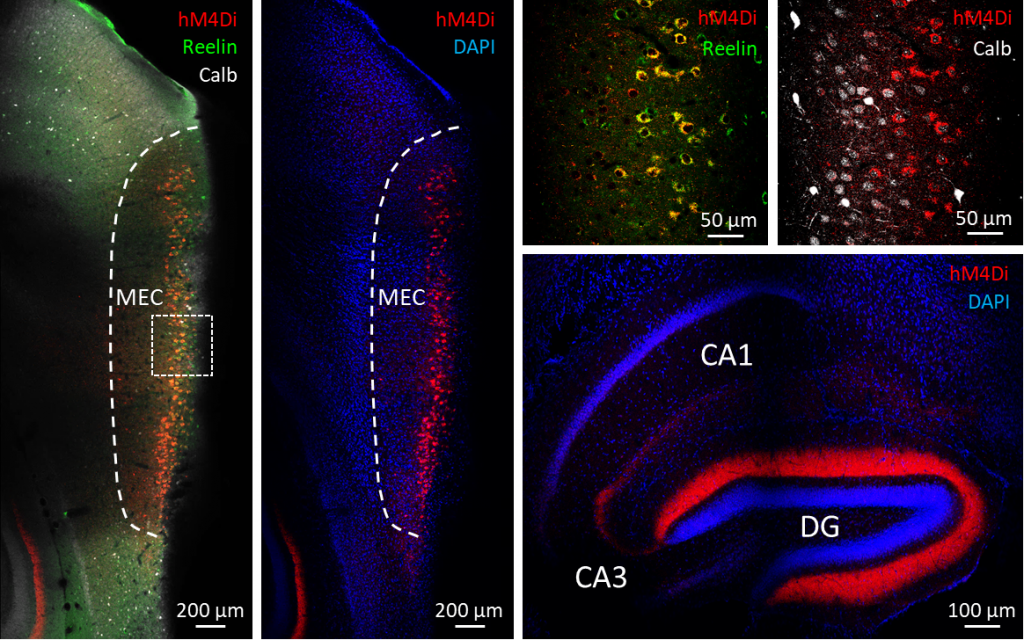
In diesem Beispiel kann die Aktivität der Sternzellen des MEC durch die Expression von hM4Di-Rezeptoren herunterreguliert werden, was uns die Möglichkeit gibt, die Bedeutung der von dieser Zellpopulation in den Hippocampus gelangenden Inputs für die Aktivität der Neuronen des Hippocampus zu bewerten.
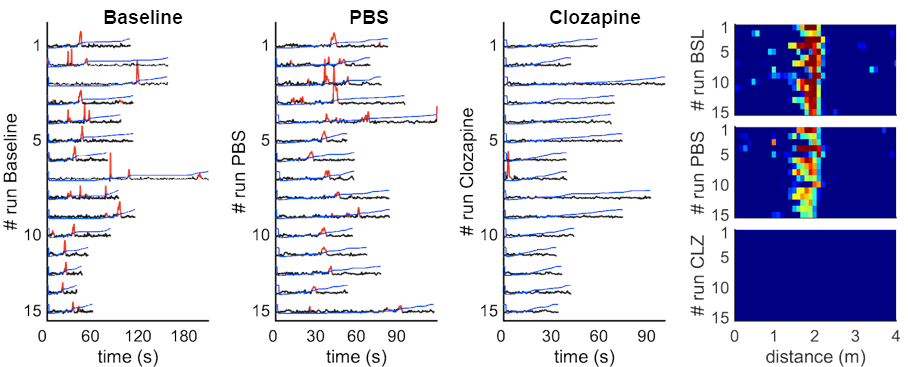
Die folgenden Kurven zeigen die Aktivität einer einzelnen Körnerzelle des Gyrus dentatus, die unter den Bedingungen der Grundlinie, PBS und Clozapin aufgezeichnet wurde. Nach Aktivierung der hMD4i-Rezeptoren, die von den stellaten Zellen der Schicht-2 des MEC exprimiert werden, durch Clozapin wird diese Körnerzelle zum Schweigen gebracht.

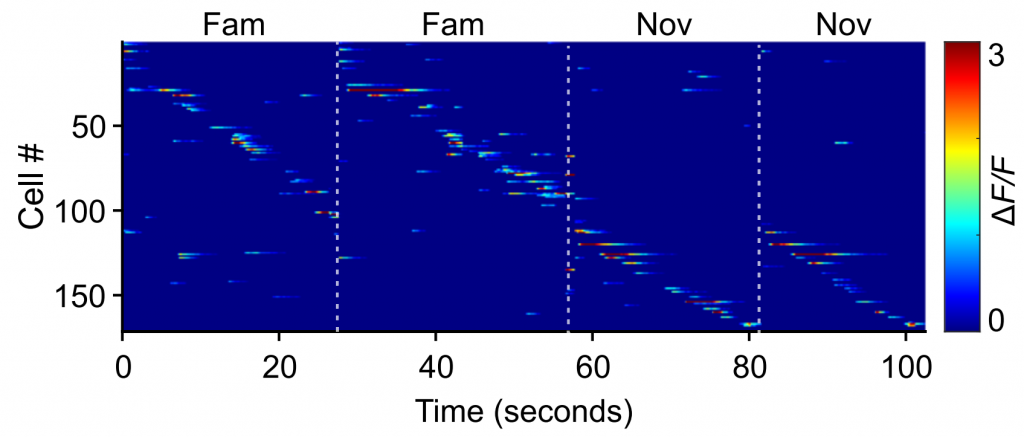
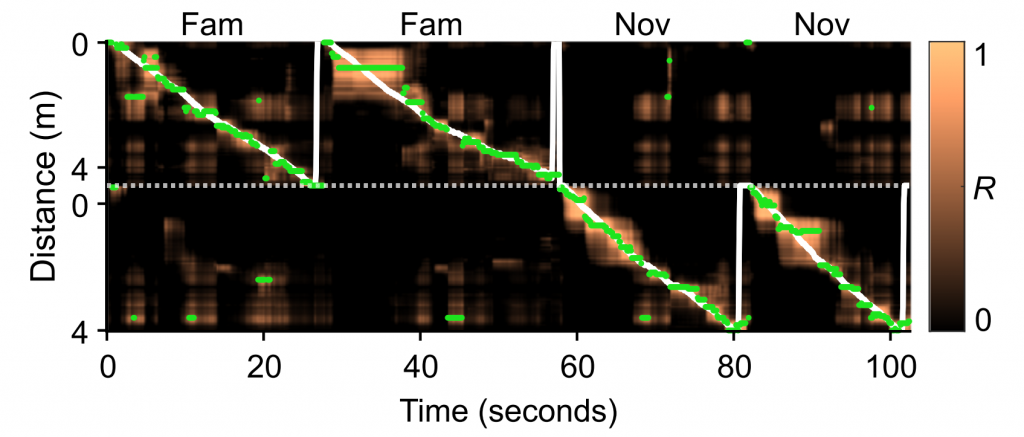
In dem hier vorgestellten Beispiel wurden aus allen aufgezeichneten Zellen einer bestimmten Sitzung zufällig Unterproben von 50 Zellen ausgewählt, entweder aus dem linken oder dem rechten Hippocampus.
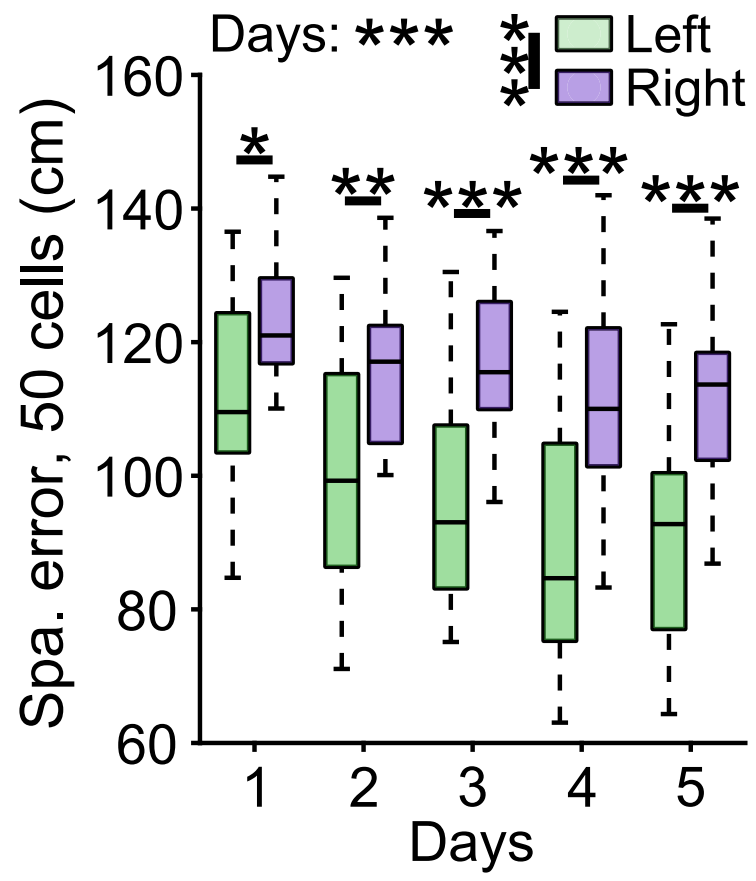
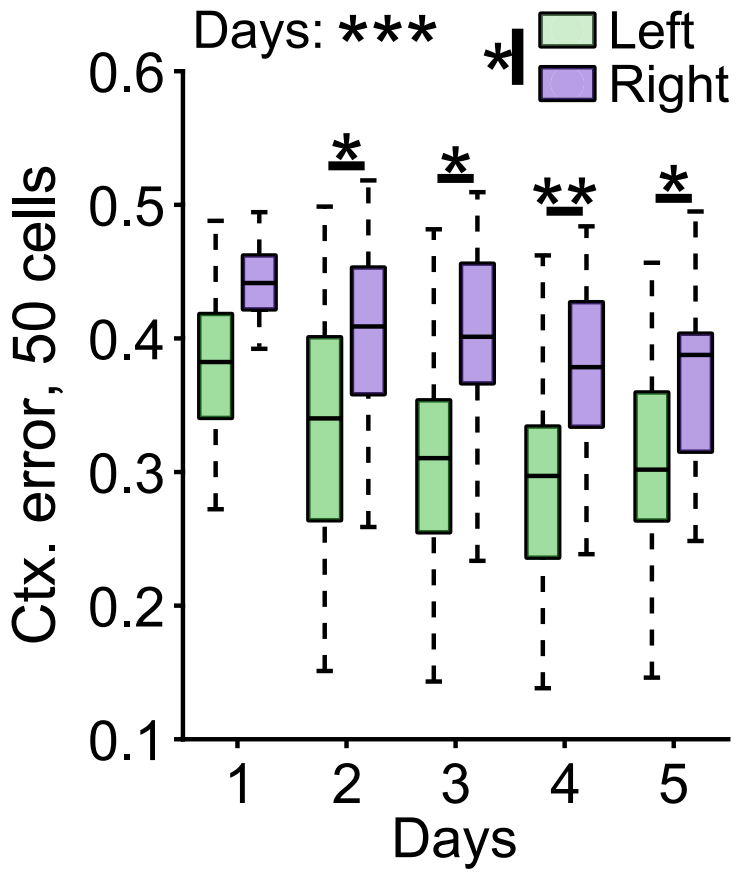
Die Dekodierleistung sowohl für den Raum als auch für den Kontext nahm im Laufe der Tage sowohl bei den linken als auch bei den rechten Körnerzellenpopulationen zu. Dennoch waren die Dekodierungsfehler bei den linken Körnerzellenpopulationen immer deutlich geringer, was darauf hindeutet, dass kontextuelle Informationen von den Körnerzellen je nach Gehirnhälfte unterschiedlich verarbeitet werden.
Veröffentlichungen
Hemisphere-specific spatial representation by hippocampal granule cells. Cholvin T, Bartos M. Nature Commun. 2022 Oct 20;13(1):6227.
The hippocampus converts dynamic entorhinal inputs into stable spatial maps. Cholvin T, Hainmueller T, Bartos M. Neuron. 2021, 109:3135-3148.e7.
Ventral midline thalamus lesion prevents persistence of new (learning-triggered) hippocampal spines, delayed neocortical spinogenesis, and spatial memory durability. Klein MM, Cholvin T, Cosquer B, Salvadori A, Le Mero J, Kourouma L, Boutillier AL, Pereira de Vasconcelos A, Cassel JC. Brain Struct Funct. 2019, 224:1659-1676.
Ventral midline thalamus is necessary for hippocampal place field stability and cell firing modulation. Cholvin T, Hok V, Chaillan FA, Giorgi L, and Poucet B. J Neurosci. 2018, 38:158-172.
Using MRI to predict the fate of excitotoxic lesions in Rats. Cholvin T, Giorgi L, Baril N, Brezun JM, Poucet B, and Chaillan FA. PLoS One. 2018, 13:e0200659.
Environmental enrichment enhances systems-level consolidation of a spatial memory after lesions of the ventral midline thalamus. Ali M, Cholvin T, Muller MA, Cosquer B, Kelche C, Cassel JC, Pereira de Vasconcelos A. Neurobiol Learn Mem. 2017, 141:108-123.
Dorsal hippocampus and medial prefrontal cortex each contribute to the retrieval of a recent spatial memory in rats. Cholvin T, Loureiro M, Cassel R, Cosquer B, Herbeaux K, de Vasconcelos AP, Cassel JC. Brain Struct Funct. 2016, 221:91-102.
The ventral midline thalamus contributes to strategy shifting in a memory task requiring both prefrontal cortical and hippocampal functions. Cholvin T, Loureiro M, Cassel R, Cosquer B, Geiger K, De Sa Nogueira D, Raingard H, Robelin L, Kelche C, Pereira de Vasconcelos A, Cassel JC. J Neurosci. 2013, 33:8772-8783.
The ventral midline thalamus (reuniens and rhomboid nuclei) contributes to the persistence of spatial memory in rats. Loureiro M, Cholvin T, Lopez J, Merienne N, Latreche A, Cosquer B, Geiger K, Kelche C, Cassel JC, Pereira de Vasconcelos A. J Neurosci. 2012, 32:9947-9959.
- The reuniens and rhomboid nuclei of the thalamus: A crossroads for cognition-relevant information processing? Cassel JC, Ferraris M, Quilichini P, Cholvin T, Boch L, Stephan A, Pereira de Vasconcelos A. Neurosci Biobehav Rev. 2021, 126:338-360.
- The reuniens and rhomboid nuclei: neuroanatomy, electrophysiological characteristics and behavioral implications. Cassel JC, Pereira de Vasconcelos A, Loureiro M, Cholvin T, Dalrymple-Alford JC, Vertes RP. Prog Neurobiol. 2013, 111:34-52

