Prof. Marlene Bartos – Forschungsgruppe Systemische und zelluläre Neurowissenschaften
Wir wollen verstehen, wie die dendritische Integration der Aktivität in den Hauptzellen und GABAergen Interneuronen die Funktion der Mikroschaltkreise und das Verhalten beeinflusst.
Forschung
Ein grundlegendes und faszinierendes Merkmal des Säugetiergehirns ist seine Fähigkeit, neue Informationen aufzunehmen und zu speichern. Unsere Forschung konzentriert sich darauf, wie das Gedächtnis in neuronalen Netzwerken repräsentiert wird. Unser Ziel ist es, die Mechanismen zu verstehen, die dem Entstehen von lernassoziierten aktiven Zellpopulationen (Zellverbänden) zugrunde liegen, die neue Erinnerungen repräsentieren. Wir konzentrieren uns auf den Gyrus dentatus (DG) von Nagetieren, die Input-Region des Hippocampus, von der bekannt ist, dass sie bei vielen Spezies, einschließlich Menschen und Nagetieren, funktionell entscheidend für den Erwerb neuer Erinnerungen ist. Unsere Arbeit hat die zellulären und synaptischen Eigenschaften von Neuronen und Synapsen im Schaltkreis der DG sowie die Mechanismen geklärt, die der Synchronisierung neuronaler Netzwerke für die Codierung von Informationen zugrunde liegen. Wir haben die zellulären, synaptischen und Netzwerkmechanismen untersucht, die für die Entwicklung neuronaler Netzwerke wichtig sind, wobei wir uns auf GABAerge inhibitorische Zellen konzentriert haben.
Unsere wichtigsten Forschungsthemen sind:
- um die räumliche und zeitliche Entstehung von lernassoziierten Zellverbänden zu verstehen, die neue Erinnerungen repräsentieren.
- die Art und Bedeutung der wichtigsten funktionellen (zellulären, synaptischen, plastischen) und strukturellen Veränderungen, die der Bildung von Zellverbänden zugrunde liegen, zu beschreiben.
- die funktionellen und dynamischen Merkmale der synaptischen Kommunikation zwischen Zellen und ihre Rolle bei der Informationsverarbeitung in kortikalen Mikroschaltkreisen zu verstehen.
- die Rolle der sehr unterschiedlichen GABAergen Zellpopulation bei der Funktion neuronaler Netzwerke und der Bildung von Zellverbänden zu ermitteln.
- um die Fehlfunktion zellulärer Komponenten in spezifischen Mausmodellen zu untersuchen, die neuronalen Erkrankungen zugrunde liegen.
Techniques
Miniskop-Bildgebung
Wir verwenden Inscopix nVoke-Systeme zur Abbildung von Ca2+-Signalen mit einer zellulären Auflösung von einem Photon in Kombination mit optogenetischer Stimulation im selben Sichtfeld, um die Zellaktivität und die Schaltkreise im Hippocampus und im präfrontalen Kortex bei frei verhaltenden Tieren zu untersuchen.
Unser Ziel ist es, die longitudinale Beteiligung von Zellensembles im präfrontalen Kortex und in Unterregionen des Hippocampus während des Arbeitsgedächtnisses, des sozialen Gedächtnisses und der räumlichen Kodierung/Diskriminierung zu verstehen. Wir wollen die Schaltkreisdynamik des Lernens, der Gedächtniskonsolidierung und des Abrufs von Kurzzeit- und Ferngedächtnis verstehen und so den Beitrag verschiedener Zelltypen und Neuromodulatoren zur Gedächtnisrepräsentation im Gehirn entschlüsseln.
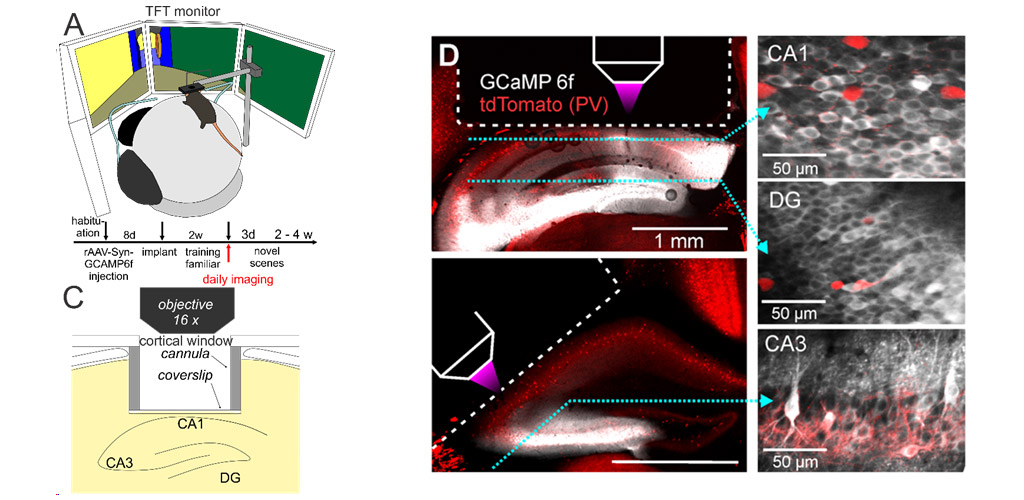
2-Photonen-Populationsbildgebung
Wir untersuchen die Entstehung und Aktivität von Gedächtnis-Engrammen im Hippocampus bei wachen, sich verhaltenden Tieren mit Hilfe der Zwei-Photonen-Kalzium-Bildgebung im Gyrus dentatus und den Hippocampus-Unterfeldern CA1-3 von Mäusen, deren Kopf fixiert ist. Mäuse führen kontextbezogene Unterscheidungsaufgaben in einer virtuellen Umgebung durch, die auf Bildschirmen um sie herum angezeigt wird.
Wir untersuchen, wie Hauptneuronen in verschiedenen Unterfeldern des Hippocampus räumliche Kontexte repräsentieren, wie sich diese Repräsentationen mit zunehmender Vertrautheit entwickeln, wie lokale Mikroschaltkreise der Bildung neuronaler Ensembles zugrunde liegen und wie die Aktivität lokaler inhibitorischer Schaltkreise durch sensorische Erfahrung und Neuheitserkennung moduliert wird.
Unser Ziel ist es zu entschlüsseln, wie neuronale Schaltkreise im Hippocampus die Inhalte komplexer episodischer Erinnerungen speichern und abrufen.
Das Video zeigt eine Maus, die auf einer Syropor-Kugel läuft, die die Navigation durch die auf den Computermonitoren angezeigte virtuelle Umgebung steuert.
Konnektivität der neuronalen Mikroschaltkreise
Um die Funktion einer bestimmten Nervenzelle (eines bestimmten Typs) genau beurteilen zu können, ist es unerlässlich, die prä- und postsynaptischen Partner dieser Zelle (dieses Typs) zu erfassen. Wir verwenden retrograde Marker wie die mit Fluoreszenzfarbstoff konjugierte Cholera-Toxin-Beta-Untereinheit (CTB) sowie retrograde & anterograde Adeno-Assoziierte Viren (AAV) verschiedener Serotypen und Canine Adeno-Virus Typ 2 (CAV2) zur fluoreszierenden Markierung neuronaler Populationen. Weitere Spezifität erhalten wir durch die Verwendung selektiver viraler Promotoren oder Cre-Recombinase-exprimierender transgener Mäuse, um spezifische neuronale Subpopulationen auf der Grundlage ihrer neurochemischen Identität oder ihres postsynaptischen Zielbereichs zu markieren. Darüber hinaus können diese Viren auch zur gleichzeitigen Expression genetisch kodierter lichtgesteuerter Ionenkanäle (Opsine) verwendet werden, um diese verschiedenen Zelltypen entweder in vivo oder in vitro zu aktivieren oder zu hemmen, was eine Analyse sowohl der strukturellen als auch der funktionellen Konnektivität ermöglicht. Wir untersuchen auch die präsynaptischen Eingänge zu den verschiedenen Zelltypen mit Hilfe der monosynaptischen Tollwutvirusverfolgung, die es uns ermöglicht, neuronale subtypabhängige Konnektivitätsmotive zwischen identifizierten prä- und postsynaptischen Neuronen im Gehirn zu bewerten.
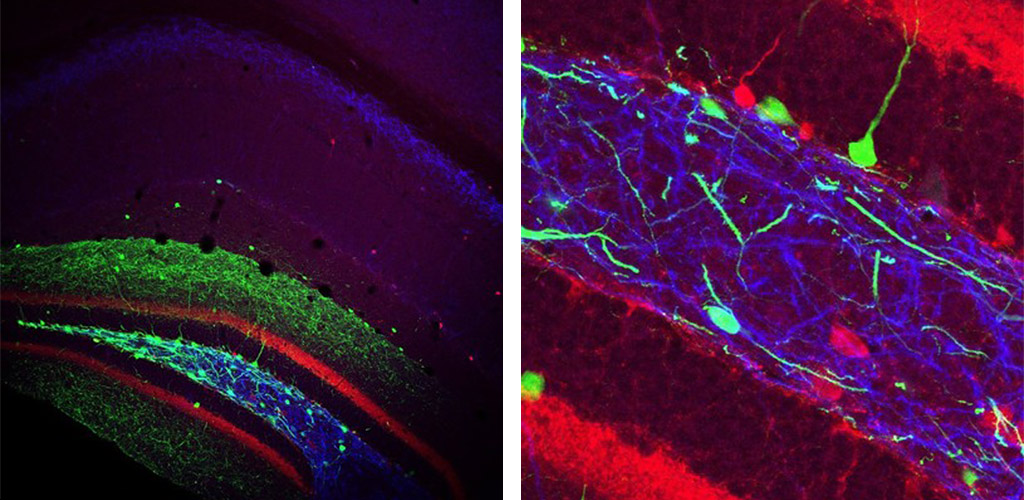
Injektion eines cre-abhängigen Virus, das GFP (grün) exprimiert, in den Gyrus dentatus einer transgenen Maus, die cre unter dem Somatostatin-Promotor exprimiert. Post-hoc-Immunmarkierung für Calbindin (rot) und mGluR1a (blau) wurde ebenfalls durchgeführt.
Left image shows the Hippocampus of a transgenic mouse that expressed cre under the Somatostatin promoter after injection of a cre-dependent, GFP-expressing virus into the Dentate Gyrus (green). Post-hoc immunolabelling for Calbindin (Ca2+ binding protein; red) and mGluR1α (metabotropic Glutamate receptor; blue) was also performed. An enlarged view is shown on the right.
Aufzeichnung mit einer Silizium-Sonde
Wir untersuchen die Dynamik des neuronalen Netzwerks mit Hilfe groß angelegter Einzelaufzeichnungen von am Kopf fixierten Mäusen, die in virtuellen Umgebungen navigieren (A). Mit mehrschenkligen Silizium-Sonden und Lichtleiter-Implantaten untersuchen wir die Aktivität von Hauptzellen des Hippocampus und optogenetisch identifizierten Interneuronen (B). Mit linearen Silizium-Sonden untersuchen wir darüber hinaus die Aktivität von Neuronen in verschiedenen Bereichen des präfrontalen Kortex bei wachen Mäusen (C). Unser Ziel ist es zu verstehen, wie neuronale Ensembles in Hippocampus und Kortex dynamisch Verhaltensvariablen kodieren.
Interneuronale Vielfalt
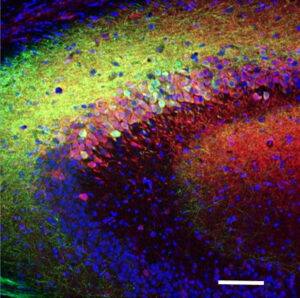
In den letzten 25 Jahren wurden zahlreiche Studien über die neurochemischen, morphologischen, physiologischen und pharmakologischen Eigenschaften von Interneuronen durchgeführt, die zur Identifizierung einer Vielzahl von anatomisch und funktionell unterschiedlichen GABAergen Interneurontypen führten. Diese Studien zeigten, dass der Zellkörper, das axoninitiale Segment und die dendritischen Bereiche von Pyramidenzellen und Interneuronen von unterschiedlichen Interneuronentypen gesteuert werden (Markram et al., 2004; Bartos et al., 2014), was darauf hindeutet, dass kompartimentspezifische Rechenoperationen auf der Ebene einzelner Zellen von spezialisierten hemmenden Zellen gesteuert werden. Die Diversität der Interneuronen wurde hauptsächlich in den CA1-3 des Hippocampus und in neokortikalen Arealen untersucht. Wir konzentrieren unsere Arbeit auf den Gyrus dentatus, das Eingangstor des Hippocampus, und verwenden dazu die intrazelluläre Markierung von Zellen in Schnittpräparaten mit anschließender Antikörpermarkierung, konfokaler und Elektronenmikroskopie. Darüber hinaus markieren wir bei transgenen Mäusen mit viraler Expression lokale und weitreichend projizierende Interneurontypen.
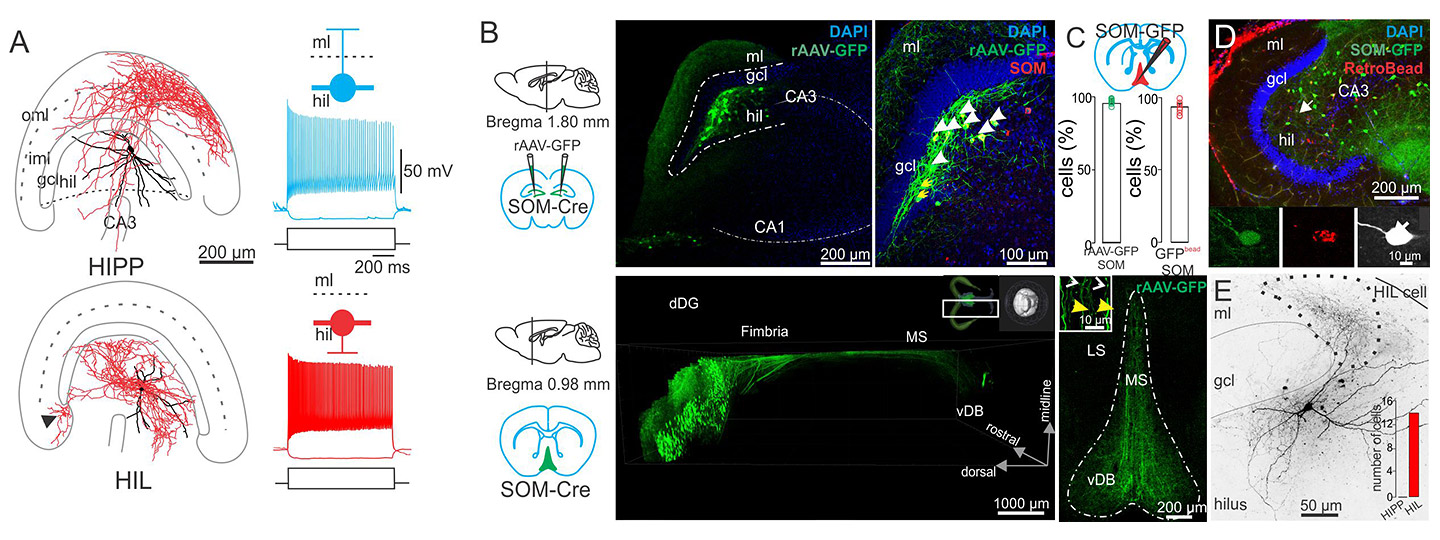
A) Morphologische Rekonstruktionen und elektrophysiologische Reaktionen auf Strominjektion für zwei verschiedene Arten von Somatostatin-exprimierenden Interneuronen mit Zellkörpern im Hilus. B) Die Injektion eines cre-abhängigen Virus in SOM-cre-Mäuse markiert Hilus-Neuronen mit GFP (grün), und die Axone können zu Zielgebieten wie dem medialen Septum (unteres Feld) verfolgt werden. DAPI (blau) ist eine zelluläre Gegenfärbung. Die Immunfärbung für Somatostatin wurde zur Bestätigung des Zelltyps verwendet (oberes rechtes Feld). C) In das mediale Septum injizierte Retrobeads (rot markiert) bestätigen, dass die GFP-exprimierenden Axone von den Hilar-Zellen stammen. D) Beispielbilder von intrazellulär gefüllten, Retrobead-markierten Hilar, Somatostatin-exprimierenden Interneuronen.
Plastizität
GABAerge inhibitorische Interneuronen (INs) im Kortex von Säugetieren zeichnen sich durch eine große Vielfalt aus, die auf ihren molekularen, morphologischen und physiologischen Eigenschaften beruht. Es wird angenommen, dass die verschiedenen IN-Typen die Aktivität und Erregbarkeit ihrer Zielzellen auf kompartimentspezifische Weise steuern. Jüngste Untersuchungen in unserer Gruppe deuten darauf hin, dass einige IN-Typen unter der Kontrolle der Plastizität stehen. In unserer Forschung konzentrieren wir uns auf die Mechanismen, die eine langfristige Verstärkung oder Abschwächung glutamaterger synaptischer Eingänge auf Parvalbumin (PV) und Somatostatin (SOM)-exprimierende Interneuronen (PVIs bzw. SOMIs) ermöglichen. Wir wollen verstehen, wie diese synaptischen plastischen Veränderungen zum Gesamtzustand der neuronalen Netzwerkaktivität, in die diese INs eingebettet sind, zur Informationsverarbeitung und zum Verhaltensergebnis beitragen. Um diese Ziele zu erreichen, verwenden wir einen multidisziplinären Ansatz, der In-vitro-Ganzzellaufnahmen, shRNA zur Beeinflussung der Induktion synaptischer Plastizität, In-vivo-Einzelzellaufnahmen von optotagged IN-Typen und Verhaltensanalysen kombiniert. Wir konzentrieren diese Untersuchungen auf PVIs und SOMIs des Gyrus dentatus bei Mäusen. Wir haben zuvor gezeigt, dass Moosfasersynapsen, die von Körnerzellen des Gyrus dentatus ausgehen, Langzeitpotenzierung (LTP) auf beide IN-Typen vermitteln. Diese Form der LTP hängt von der Aktivierung metabotroper Glutamatrezeptoren der Gruppe I ab (Sambandan et al., J Neurosci 2010; Hainmueller & Bartos, PNAS USA 2014; Yuan et al, eLife 2017).
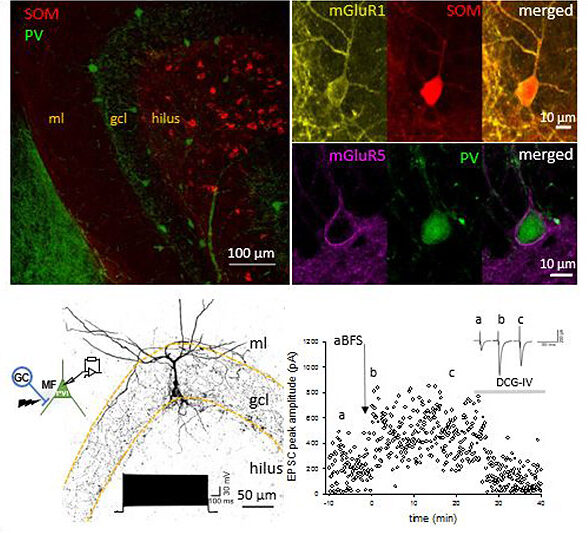
Bild oben links: kombinierte Immunmarkierung für Parvalbumin (PV; grün) und Somatostatin (SOM; rot) im Gyrus Dentatus. Bild oben rechts: Beispiele für Immunmarkierungen für den metabotropen Glutamatrezeptor Typ 1 (mGluR1; gelb), der von SOM-Interneuronen (rot) exprimiert wird, und für den metabotropen Glutamatrezeptor Typ 5 (mGluR5; magenta), der von PV-Interneuronen (grün) exprimiert wird. Das untere Feld zeigt die Morphologie und Elektrophysiologie einer gepaarten Aufzeichnung zwischen einer Körnerzelle und einem PV-exprimierenden Interneuron im Gyrus dentatus während eines assoziativen Burst-Frequenz-Stimulationsprotokolls, das eine lang anhaltende Verstärkung der Erregung des Interneurons bewirkt. Dies wird dann durch DCG-IV rückgängig gemacht.
Ausgewählte Veröffentlichungen
Originalarbeiten
2023
2022
- Cholvin T, Bartos M (2022) Hemisphere-specific spatial representation by hippocampal granule cells. Nature Com. DOI: 10.1038/s41467-022-34039-5.
- Strüber M, Sauer JF, Bartos M (2022) Parvalbumin expressing interneurons control spike-phase coupling of hippocampal cells to theta oscillations. Sci Rep. 112:1362
- Sauer JF, Folschweiller S, Bartos M (2022) Topographically organized representation of space and context in the medial prefrontal cortex. PNAS 119 (6) e2117300119.
2021
2020
- Hainmueller T, Bartos M (2020) Dentate gyrus circuits for encoding, retrieval and discrimination of episodic memories. Nature Rev Neurosci, 21:153-68.
- Paschen E, Elgueta C, Heining K, Vieira D, Kleis P, Orcinha C, Häussler U, Bartos M, Egert U, Janz P, Haas C (2020) Hippocampal low-frequency stimulation prevents seizure generation in a mouse model of mesial temporal lobe epilepsy. elife 10.7554/elife.54518.
2019
- Elgueta C, Bartos M (2019) Dendritic inhibition differentially regulates excitability of dentate gyrus parvalbumin-expressing interneurons and granule cells. Nature Comm 10:5561. https://doi.org/10.1038/s41467-01913533-3.
- Eyre MD, Bartos M (2019) Somatostatin-Expressing Interneurons Form Axonal Projections to the Contralateral Hippocampus. Front Neural Circuits, 13:56. Published 2019 Aug 23. doi:10.3389/fncir.2019.00056
- Holz A, Mülsch F, Schwarz MK, Hollmann M, Döbrössy MD, Coenen VA, Bartos M, Normann C, Biber K, van Calker D, Serchov T (2019) Enhanced mGlu5 signaling in excitatory neurons promotes rapid antidepressant effects via AMPA receptor activation. Neuron. 2019 Jul 23. pii: S0896-6273(19)30637-3. doi: 10.1016/j.neuron.2019.07.011.
2018
- Hainmüller T, Bartos M (2018) Parallel emergence of stable and dynamic memory engrams in the hippocampus. Nature 558:292-96.
- Sauer JF, Strüber M, Bartos M (2018) Recording Spatially Restricted Oscillations in the Hippocampus of Behaving Mice. Jove-j Vis Exp doi:10.3791/57714.
2017
- Strüber M, Sauer JF, Jonas P, Bartos M (2017) Distance-dependent inhibition supports focality of gamma oscillations. (2017) Nature Commun. DOI: 10.1038/s41467-017-00936-3.
- Yuan M, Meyer T, Benkowitz C, Savanthrapadian S, Ansel-Bollepalli L, Foggetti A, Wulff P, Alcami P, Elgueta C, Bartos M (2017) Somatostatin-positive interneurons in the dentate gyrus of mice provide local- and long-range septal synaptic inhibition. eLife 2017;6 e21105
- Biskamp J, Bartos M, Sauer JF (2017) Organization of prefrontal network activity by respiration-related oscillations. Sci Rep 7:45508
2016
2015
- Elgueta C, Köhler J, Bartos M (2015) Persistent discharges in dentate gyrus perisoma-inhibiting interneurons require hyperpolarization-activated cyclic nucleotide-gated channel activation. J Neurosci 35:4131-4139
- Sauer JF, Strüber M, Bartos M (2015) Impaired fast-spiking interneuron function in a genetic mouse model of depression. eLife 2015;10.7554/eLife.04979
- Strüber M, Jonas P, Bartos M (2015) Strength and duration of perisomatic GABAergic inhibition depend on distance between synaptically connected cells. PNAS USA ePub ahead of print; doi:10.1073/pnas.1423628112
2014
- Hainmüller T, Krieglstein K, Kulik A, Bartos M (2014) Joint CP-AMPA and group I mGlu receptor activation is required for synaptic plasticity in dentate gyrus fast-spiking interneurons. PNAS USA 111:13211-13216.
- Savanthrapadian S, Meyer T, Elgueta C, Booker S, Vida I, Bartos M (2014) Synaptic properties of SOM- and CCK-expressing cells in dentate gyrus interneuron networks. J Neurosci 34:8197-8209.
2013
2012
- Bartos M, Elgueta C. (2012) Functional characteristics of parvalbumin- and cholecystokinin-expressing basket cells. J Physiol (Lond) 590:669-681.
- Sauer J-F, Strüber M, Bartos M (2012) Interneurons provide circuit-specific depolarization and hyperpolarization. J Neurosci 32:4224-4229.
2011
2010
2009
2008
2007
2006