Prof. Dr. Johannes Letzkus – Labor für neokortikale Schaltkreise
Informationen über vergangene Erfahrungen und aktuelle Ziele sind ein zentrales Element aller höheren Hirnfunktionen, aber unser Verständnis dieser intern erzeugten Top-down-Signale in Gesundheit und Krankheit ist begrenzt. Wir nutzen eine Kombination aus Bildgebung, Elektrophysiologie, zelltypspezifischem Targeting, Optogenetik, viraler Verfolgung und Verhalten, um diese Mechanismen im auditorischen Kortex zu untersuchen.
Forschung
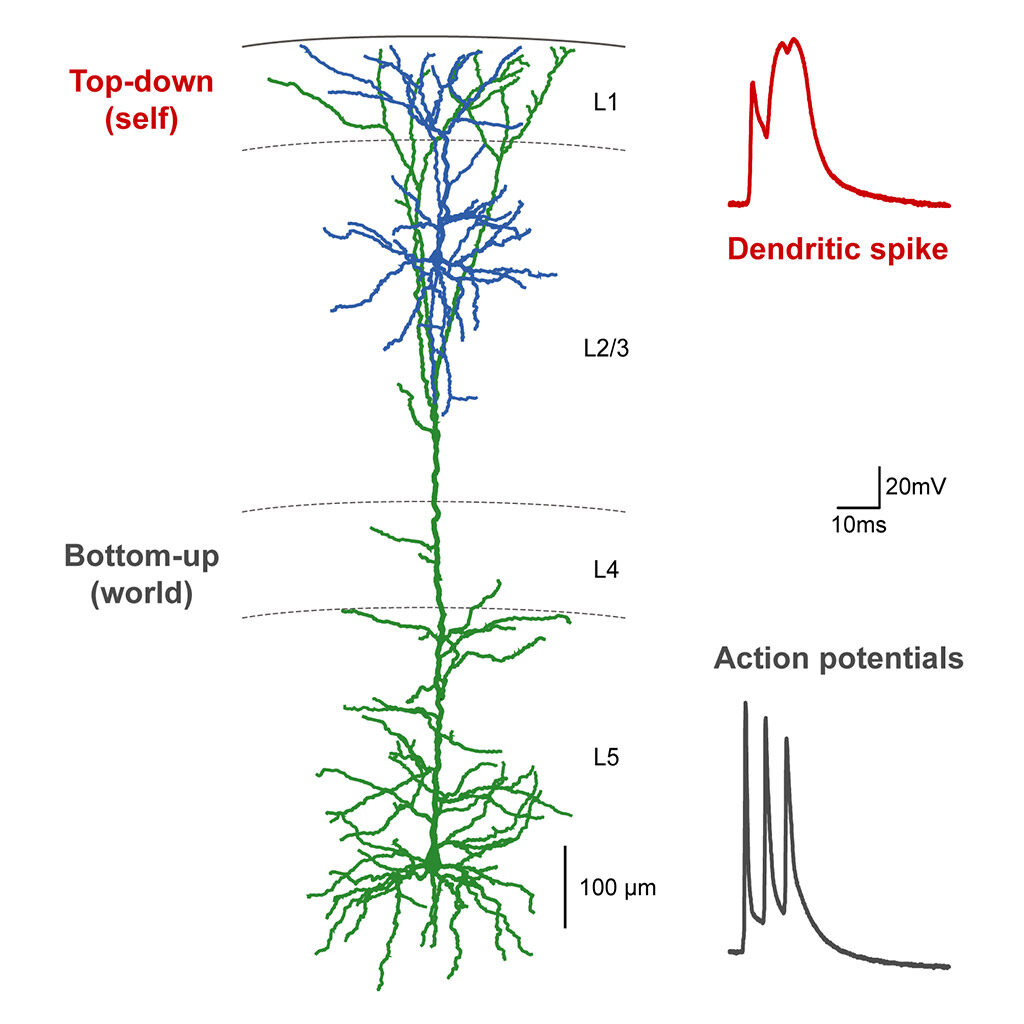
Der Neokortex ist der größte und leistungsfähigste Bereich des Säugetiergehirns. Diese Region hat sich im Laufe der Evolution am stärksten ausgedehnt und differenziert, vermittelt viele der Fähigkeiten, die den Menschen von seinen nächsten Verwandten unterscheiden, und spielt auch bei vielen psychiatrischen Störungen eine zentrale Rolle. Alle höheren kognitiven Funktionen des Neokortex werden dadurch ermöglicht, dass zwei unterschiedliche Informationsströme zusammengeführt werden: ein „Bottom-up“-Stream, der Signale aus der Umgebung übermittelt, und ein „Top-down“-Stream, der intern erzeugte Informationen weiterleitet, die unsere früheren Erfahrungen und aktuellen Ziele kodieren.
Während sich jahrzehntelange Arbeiten mit der Verarbeitung sensorischer Bottom-up-Informationen befasst haben, steckt unser Verständnis der intern erzeugten Informationen noch in den Kinderschuhen.
Techniken
Unsere Arbeit zielt darauf ab, diese Lücke zu schließen, indem wir die Mechanismen und Folgen der Top-down-Informationsverarbeitung im auditorischen Kortex aufklären. Mit einer Kombination aus modernsten Ansätzen (einschließlich 2-Photonen- und 1-Photonen-Bildgebung, Elektrophysiologie, Optogenetik, virales Tracing und computergestützte Analysen) und Verhaltensparadigmen gehen wir den folgenden Fragen nach:
1) Welche hirnweiten Afferenzen übermitteln welche Art von Top-down-Informationen an den Neokortex?
2) Wie werden diese Top-Down-Signale von lokalen inhibitorischen Interneuronen umgesetzt, um die Schaltkreisfunktion flexibel anzupassen?
3) Welche Aspekte der Informationsverarbeitung unterliegen der Top-down-Modulation?
4) Wie optimiert die Top-down-Information die Gehirnfunktion für komplexe, naturalistische Verhaltensweisen?
5) Wie tragen Störungen der Top-down-Prozesse zu Hirnleistungsstörungen bei?
Publikationen
Schroeder A1, Letzkus JJ2,3 (2021). A neuropeptide making memories. Cell, 184, 5501-5503.
Highlighted by: Lewis S. (2020) Nature Reviews Neuroscience.
Pardi MB1, Abs E, Letzkus JJ2,3 (2019). Disinhibition goes spatial. Neuron, 101:994-996.
Highlighted by: Hou WH & Capogna M (2018) Neuron 100, 516-519.
Highlighted by: Ozawa T & Johansen JP (2014) Current Biology 24, R690-693.
Highlighted by: Flight MH (2011). Nat Rev Neurosci 13, 72.
Letzkus JJ1,2, Stuart GJ2 (2008) All asleep-but inhibition is wide awake. Neuron 57:804-806.
(1first author, 2corresponding author, 3lead author)