P.D. Dr. Armin Just – Labor für Nierenhämodynamik
Wir untersuchen die Mechanismen, die den Blutfluss und die Filtrationsrate in der Niere steuern, angefangen bei lokalen Mediatoren und Signalwegen bis hin zur integrierten Funktion der druckabhängigen Autoregulation.
Forschung
Unser Ziel ist es, die Mechanismen zu verstehen, die an der Kontrolle des renalen Blutflusses und der glomerulären Filtrationsrate beteiligt sind. Dies betrifft lokale Mediatoren wie Stickstoffmonoxid (NO), Prostaglandine und EDHF, intrazelluläre Signalwege und Connexine, Hormone, Nierennerven sowie die Mediatoren und Modulatoren der renalen Autoregulation.
Neuere Studien
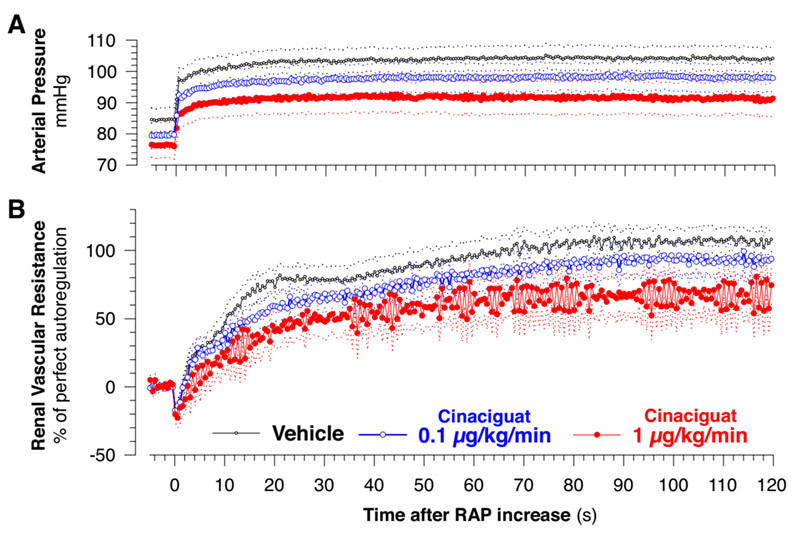
In (Dautzenberg et al. 2014) untersuchten wir die Rolle der löslichen Guanylatzyklase (sGC) bei der Regulierung des renalen Blutflusses und der glomerulären Filtrationsrate sowie bei der NO-abhängigen Modulation der Autoregulation des renalen Blutflusses. sGC ist ein Enzym, das zyklisches Guanosinmonophosphat (cGMP) produziert, und ist das Hauptziel für die Wirkungen von NO. Aufgrund dieser Eigenschaften ist sGC ein wichtiger Akteur in der cGMP-Signalkaskade. Es wurden pharmakologische Wirkstoffe entwickelt, die direkt auf sGC abzielen, so genannte sGC-Stimulatoren und -Aktivatoren, von denen einige bereits als Therapeutika zugelassen sind. Über ihren Einfluss auf die Nierenhämodynamik ist jedoch wenig bekannt. Obwohl die sGC als Hauptziel für NO angesehen wird, sind auch andere Signalwege für NO beschrieben worden. Wir untersuchten daher die Auswirkungen eines prominenten sGC-Aktivators, Cinaciguat, auf den Blutfluss, die Filtrationsrate und die Autoregulation und untersuchten außerdem, inwieweit die Wirkungen von endogenem NO über sGC vermittelt werden. Die Infusion von Cinaciguat bei betäubten Ratten führte nicht zu einer Verringerung des Blutflusses oder der Filtrationsrate und beeinträchtigte die Autoregulation nur geringfügig, obwohl eine erhebliche Hypotonie vorlag. Dies deutet auf die Sicherheit von Cinaciguat in Bezug auf die Nierenfunktion hin. Die Hemmung der endogenen NO-Produktion löste die bekannten Veränderungen des Blutdrucks, des renalen Blutflusses und der Autoregulation aus. Zusätzliches Cinaciguat normalisierte diese Veränderungen um ~80% für den mittleren Druck und den Fluss und um ~90% für die Autoregulation, was darauf hindeutet, dass diese Wirkungen von endogenem NO vorwiegend über sGC vermittelt werden.
Die Dynamik der Mechanismen, die der Endothel-abhängigen Vasodilatation in der Niere zugrunde liegen, wurde in Dautzenberg & Just 2013 untersucht. Es ist bekannt, dass die Endothel-abhängige Vasodilatation durch Stickstoffmonoxid (NO), Prostaglandine (PG) und endothel-derivierte hyperpolarisierende Faktoren (EDHF) vermittelt wird. Wir untersuchten den Beitrag und die zeitlichen Verläufe dieser drei Komponenten bei den gefäßerweiternden Reaktionen auf Acetylcholin (ACh) und Bradykinin (BK). Wir fanden heraus, dass NO, PG und EDHF zu >50 %, 20-40 % bzw. <20 % beitragen und dass EDHF wesentlich schneller und vorübergehender wirkt (Maximum nach 16 s) als NO und PG (Maximum nach ~30 s). Wir untersuchten auch die Beteiligung und Dynamik von NO und PG bei der Abschwächung der konstriktiven Reaktionen auf Noradrenalin und Angiotensin II. Wir fanden heraus, dass diese dämpfenden Einflüsse nicht zeitlich konstant sind, sondern ihre stärkste Wirkung später als der Höhepunkt der Konstriktion entfalten. Dementsprechend reduzieren diese Einflüsse nicht nur das Ausmaß, sondern auch die Dauer der Konstriktion.
In Dautzenberg et al. 2011 untersuchten wir die Rolle der drei Isoformen des NO-produzierenden Enzyms NO-Synthase (NOS), d.h. endotheliale (eNOS), neuronale (nNOS) und induzierbare NOS (iNOS), bei der Modulation der Autoregulation des renalen Blutflusses. Es ist bekannt, dass die Isoformen in verschiedenen Zelltypen exprimiert werden: eNOS in den Endothelzellen der afferenten Arteriole, nNOS in der Macula densa (d.h. dem Sensor für TGF) und iNOS in mesangialen und vaskulären glatten Muskelzellen. Selektive nNOS- oder iNOS-Inhibitoren hatten bei Ratten keinen Einfluss auf die Autoregulation, obwohl ein Inhibitor aller drei NOS-Isoformen bei denselben Tieren die erwartete Modulation auslöste. nNOS-Knockout (ko)-Mäuse zeigten die gleiche Autoregulation wie ihre Wildtyp-Kontrollen und reagierten normal auf den nicht-selektiven NOS-Inhibitor. Die eNOS-ko-Tiere konnten jedoch das Gleichgewicht der autoregulatorischen Mechanismen als Reaktion auf die NOS-Hemmung nicht verschieben, was auf eine wichtige Rolle von eNOS für diesen modulierenden Einfluss von NO hinweist. Zusammengenommen deuten diese Ergebnisse darauf hin, dass der modulierende Einfluss von NO auf die renale Autoregulation überwiegend, wenn nicht ausschließlich, durch NO von eNOS, nicht aber von nNOS oder iNOS vermittelt wird.
In einer Zusammenarbeit mit C. Wagner und A. Kurtz aus Regensburg, C. De Wit aus Lübeck und W.J. Arendshorst aus Chapel Hill (Just et al 2009) untersuchten wir die Rolle des Gap Junction Proteins Connexin 40 (Cx40) bei der Autoregulation des renalen Blutflusses. Es ist bekannt, dass Cx40 in dem relevanten Bereich der Niere (dem so genannten juxtaglomerulären Apparat, JGA) exprimiert wird und an der Regulierung von Renin beteiligt ist. Unsere Studie ergab, dass Cx40 einen wichtigen Beitrag zur TGF-Komponente der Autoregulation des renalen Blutflusses leistet. Diese Funktion von Cx40 kann nur teilweise durch ein anderes Connexin, Cx45, ersetzt werden, wenn es unter dem Cx40-Promotor anstelle von Cx40 exprimiert wird. Das Knockout von Cx40 allein hatte jedoch keinen Einfluss auf den modulierenden Einfluss von NO oder auf vasomotorische Reaktionen auf Noradrenalin, Angiotensin II oder Acetylcholin.
Aktuelle Arbeiten
Gegenwärtig untersuchen wir die Rolle endogener Prostaglandine und den Einfluss der Salzaufnahme auf die Autoregulation des Nierendurchflusses. Insbesondere wollen wir herausfinden, ob gefäßerweiternde Prostaglandine wie PGE2 und PGI2 den Beitrag der MR in ähnlicher Weise abschwächen könnten, wie dies zuvor für NO beobachtet wurde. Diese Hypothese basiert auf den bekannten Ähnlichkeiten und Wechselwirkungen zwischen den Signalwegen für PGE2 und PGI2 (über cAMP) und NO (über cGMP). Wir fragen uns auch, ob der Konstriktor Prostaglandin TXA2 TGF und seinen autoregulatorischen Beitrag in vivo verstärkt, wenn er mit MR und dem dritten Mechanismus in der intakten Niere in ähnlicher Weise interagiert, wie es in der Literatur beschrieben wurde, wenn TGF isoliert untersucht wurde. Schließlich wollen wir klären, ob die renale Autoregulation durch die Salzaufnahme verändert wird und welche Rolle die Prostaglandine bei dieser Anpassung spielen. Letzteres stützt sich auf Literaturberichte, wonach TXA2 die TGF nur bei hoher, nicht aber bei niedriger Salzzufuhr erhöht. Um die Rolle der Prostaglandin-produzierenden Enzyme Cyclooxygenase COX1 und COX2 zu untersuchen, untersuchten wir die RBF-Autoregulation vor und nach nicht-selektiven COX1/2- und nach COX1- und COX-2-selektiven Inhibitoren, bei normaler, salzarmer und salzreicher Ernährung.
Die bisherigen Ergebnisse deuten im Allgemeinen darauf hin, dass sowohl die nicht-selektive COX1/2-Hemmung als auch die selektive COX1- und COX2-Hemmung die MR nicht beeinträchtigen, aber die Oszillation und die Stärke des TGF sowie die gesamte Autoregulationskapazität herabsetzen. Eine Salzrestriktion scheint die Oszillation von TGF leicht zu verstärken, aber MR, der dritte Mechanismus und die gesamte Autoregulation wurden durch die Salzaufnahme nicht beeinflusst.
Techniken
Wir untersuchen betäubte Ratten und Mäuse, einschließlich Gen-Knockout-Tiere. Wir messen den arteriellen Druck und den Blutfluss in den Nieren mit Druckwandlern, die an arterielle Katheter angeschlossen sind, und mit Miniatur-Ultraschall-Laufzeit-Flusssensoren (Transonic®), die in die linke Nierenarterie implantiert werden. Die glomeruläre Filtrationsrate wird mittels klassischer Clearance unter Verwendung von fluoreszenzmarkiertem Sinistrin als Marker mit unserem maßgeschneiderten Analysealgorithmus zur Verbesserung der Genauigkeit gemessen. Zu den experimentellen Eingriffen gehören die Manipulation des arteriellen Drucks und die Infusion von Wirkstoffen intravenös oder direkt in die Nierenarterie. Für die Analyse setzen wir computergestützte Analysewerkzeuge im Zeit- und Frequenzbereich ein, wie z. B. die Mittelwertbildung von Signalen, angepasste Normalisierungsverfahren, Fourier-Transformationen und die Analyse von Übertragungsfunktionen.
Kollaborationen
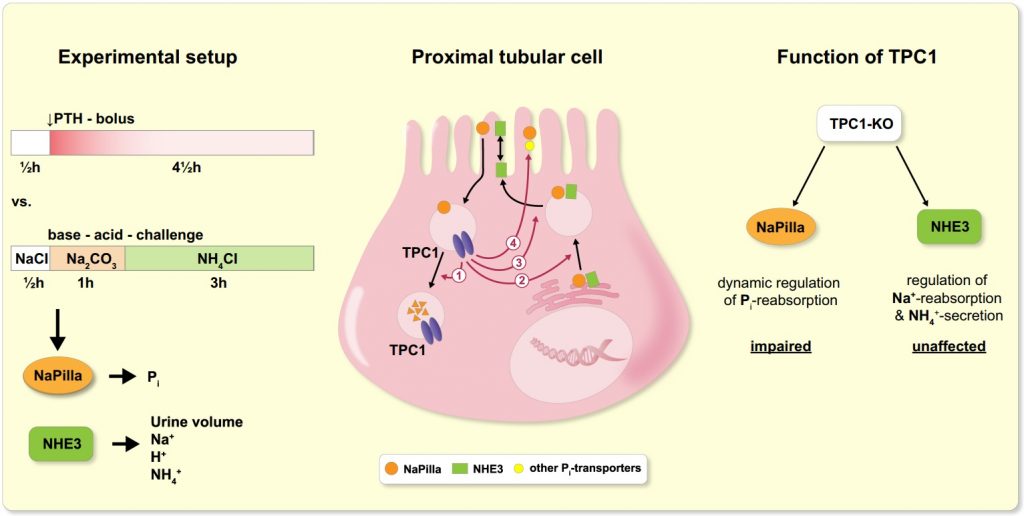
Wir haben kürzlich die Lokalisierung des TPC-Proteins 1 (TPC1) in der Niere und seine funktionelle Rolle bei der dynamischen Regulierung des tubulären Transports untersucht.
Zweiporige Kanäle (TPCs) bilden eine kleine Familie von Kationenkanälen, die in endo-lysosomalen Kompartimenten exprimiert werden. Sie wurden als kritische Elemente charakterisiert, die die Ca2+-vermittelte vesikuläre Membranfusion kontrollieren und dadurch den endo-lysosomalen Vesikeltransport regulieren. Exo- und endozytotischer Transport und lysosomaler Abbau sind wichtige Anpassungsmechanismen des epithelialen Transports – ein Paradebeispiel für einen stark regulierten epithelialen Transport ist das tubuläre System der Niere.
Wir fanden heraus, dass TPC1 subapikal im proximalen, aber nicht im distalen Tubulus exprimiert wird und eine wichtige Rolle bei der dynamischen Anpassung der proximalen tubulären Phosphatrückresorption in Richtung einer erhöhten, aber nicht reduzierten Absorption spielt.
Veröffentlichungen
Originalpublikationen
Review
Leitartikel
Vollständige Publikationsliste
Vollständige Liste der Veröffentlichungen von A. Just anzeigen